Etat de l’art
Dans l’équipe B2iHP, nous nous intéressons aux interactions entre les lépidoptères ravageurs de culture et leurs ennemis naturels, les hyménoptères parasitoïdes. Nous nous intéressons en particulier aux facteurs qui permettent aux hyménoptères de se développer dans leurs hôtes (en général des arthropodes).
Les insectes parasitoïdes sont caractérisés par une vie libre à l’état adulte et parasitaire à l’état larvaire. Il existe des milliers d’espèces de parasitoïdes, avec des modes de vie très diversifiés. Certains se développent à l’extérieur de leur hôte (ectoparasitoïdes), d’autres à l’intérieur (endoparasitoïdes), certains parasitent des œufs d’insectes, d’autres des larves ou des nymphes (parasitoïdes oophages, larvaires ou nymphaux). En règle générale, les parasitoïdes conduisent à la mort de leur hôte, expliquant ainsi pourquoi ces espèces sont fréquemment utilisées dans des programmes de lutte biologique contre les insectes ravageurs des cultures.
Les parasitoïdes que nous étudions dans l’équipe sont des espèces endoparasitoïdes de la famille des Ichneumonides, dont le développement larvaire s’effectue à l’intérieur d’une larve d’insecte. Nous nous intéressons plus particulièrement aux espèces dont les femelles sont capables, grâce à la présence de séquences virales endogènes dans leur génome, de produire dans leurs ovaires des particules de type viral. Lorsqu’elle pond son œuf dans un autre insecte (généralement une larve de lépidoptère), la femelle parasitoïde y injecte aussi ces particules lesquelles sont nécessaires au développement larvaire de la progéniture (Figure 1). Selon l’espèce de parasitoïde, ces particules de type viral renferment des molécules qui peuvent être de nature différente ; elles peuvent ainsi contenir soit des protéines (par exemple chez l’espèce Venturia canescens), soit des molécules d’ADN double brin, ce qui est le cas de la majorité des espèces étudiées à ce jour (par exemple l’espèce Hyposoter didymator). Les particules contenant des molécules d’ADN appartiennent à la famille des Polydnavirus (PDV), famille reconnue par l’International Committee on Taxonomy of Viruses (ICTV) dans les années 90.
|
|
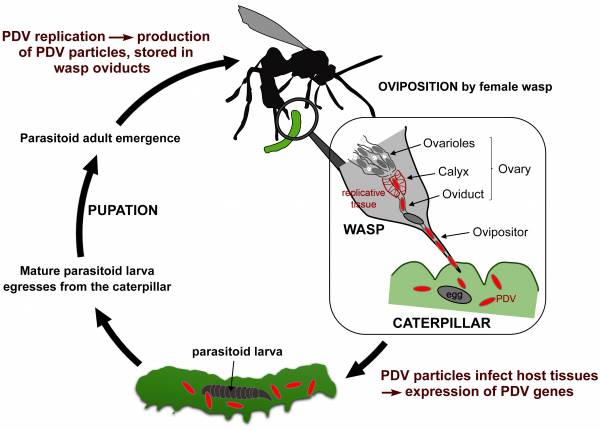
Figure 1. Cycle de vie d'une guêpe parasitoïde. Exemple d’une espèce associée à un polydnavirus (PDV). Les particules virales sont produites dans les ovaires des femelles pendant leurs stades nymphal et adulte. La production se fait exclusivement dans un tissu spécialisé, le calyx. Les particules virales produites sont libérées dans les oviductes, puis injectées dans l'insecte hôte (ici une chenille) lorsque la guêpe pond ses œufs. Une fois dans la chenille, les particules de PDV infectent tous les tissus de l'insecte, et les gènes codés par les molécules d’ADN empaquetées sont exprimés. L'expression de ces gènes transférés via les particules conduit à des altérations physiologiques de la chenille qui sont bénéfiques et souvent nécessaires au développement de l’endoparasitoide (inhibition de la réponse immunitaire de la chenille hôte, modulation de son développement, etc.). Une fois que la larve (ou les larves) du parasitoïde a terminé son développement, elle sort de la chenille, qui meurt peu après. Le parasitoïde tisse ensuite un cocon dans lequel la nymphose a lieu, conduisant à l'émergence d'une nouvelle guêpe adulte. Figure extraite de la publication de l’équipe DOI : 10.1016/B978-0-12-809633-8.21556-2. |
Les premières études sur les PDV remontent aux années 70. Leur nom « polydnavirus » découle du fait que les particules présentes dans les ovaires des femelles parasitoïdes renferment plusieurs molécules d’ADNdb circulaires. Des PDV ont été identifiés chez des espèces de parasitoïdes appartenant à deux grandes familles d’hyménoptères, les Braconidae et les Ichneumonidae, définissant deux taxa de PDV, les Bracovirus et les Ichnovirus, respectivement.
L’association parasitoïde-PDV représente un modèle unique de domestication d’un virus par un organisme eukaryote à son propre avantage. En effet, les PDV actuels dérivent de l’intégration d’un génome viral au cours de l’évolution des parasitoïdes. On sait aujourd’hui que les bracovirus résultent de l’intégration d’un génome de nudivirus chez un braconide ancêtre (Bézier et al, 2009), alors que les ichnovirus proviennent de l’intégration d’un génome viral dont l’identité n’est pas encore déterminée chez un ichneumonide ancêtre (Volkoff et al, 2010). Suite à cet évènement d’intégration, une grande partie du génome viral a été maintenue dans les chromosomes des guêpes parasitoïdes. C’est l’activation de ces séquences virales conservées dans le génome de la guêpe, qui se produit spécifiquement dans les ovaires des parasitoïdes femelles, qui conduit à la production des particules nécessaires à la réussite parasitaire.
Notre principal modèle d’étude dans l’équipe est la guêpe ichneumonide campoplegine Hyposoter didymator, parasitoïde naturel de chenilles de l’espèce Helicoverpa armigera et d’autres noctuelles ravageurs des cultures. H. didymator est associée au PDV de type Ichnovirus HdIV (Hyposoter didymator Ichnovirus). L’analyse du génome de la guêpe a montré que le génome viral endogène était composé de régions virales dispersées dans le génome de la guêpe (Legeai et al, 2020). Il comporte d’une part des régions portant des gènes provenant de l’ancêtre viral, ou « gènes de réplication », car impliqués dans la production des particules, et d’autre part des séquences servant de matrice aux molécules d’ADN circulaires, ou « segments » (Figure 2). Seuls les segments sont incorporés dans les particules et donc transférés lors du parasitisme ; les gènes de réplication quant à eux restent résidents chez la guêpe.
Les objectifs principaux de l'équipe sont :
De comprendre les mécanismes moléculaires sous-tendant les deux étapes clefs du cycle de vie du complexe parasitoïde-PDV :
- La production de particules, qui a lieu spécifiquement dans les cellules du calyx du parasitoïde.
- La manipulation de la physiologie de l’insecte parasité par le PDV, qui permet in fine le développement larvaire du parasitoïde.
Pour cela, 2 axes de recherche complémentaires sont abordés :
Axe de recherche 1. Mécanismes en jeu lors de la production des particules de PDV chez le parasitoïde. Nous nous intéressons dans cet axe à mieux comprendre les étapes de la réplication virale conduisant à la production de particules spécifiquement dans les cellules du calyx pendant les stades nymphal et adulte du parasitoïde femelle.
Axe de recherche 2. Mécanismes moléculaires mis en jeu dans les interactions hôte-PDV : impact sur la réponse immunitaire. Dans cet axe, nous nous intéressons aux conséquences physiologiques, cellulaires et moléculaires de l’infection virale pour la chenille parasitée et à la fonction des protéines virales exprimées au cours du parasitisme.
En parallèle, nous nous intéressons de façon plus large à la diversité des associations virus - guêpes ichneumonides.
Publications phare
Legeai, F., Santos, B. F., Robin, S., Bretaudeau, A., Dikow, R. B., Lemaitre, C., Jouan, V., Ravallec, M., Drezen, J.-M., Tagu, D., Baudat, F., Gyapay, G., Zhou, X., Liu, S., Webb, B. A., Brady, S. G., Volkoff, A.-N. 2020. Genomic architecture of endogenous ichnoviruses reveals distinct evolutionary pathways leading to virus domestication in parasitic wasps. BMC Biology, 18. DOI : 89.10.1186/s12915-020-00822-3.
Lorenzi, A., Ravallec, M., Eychenne, M., Jouan, V., Robin, S., Darboux, I., Legeai, F., Gosselin-Grenet, A.S., Sicard, M., Stoltz, D., Volkoff, A.N. 2019. RNA interference identifies domesticated viral genes involved in assembly and trafficking of virus-derived particles in ichneumonid wasps. PLoS Pathogens 15 (12), e1008210. DOI : 10.1371/journal.ppat.1008210.
Visconti, V., Eychenne, M., Darboux, I. 2019. Modulation of antiviral immunity by the ichnovirus HdIV in Spodoptera frugiperda. Molecular Immunology, 108, 89-101. DOI : 10.1016/j.molimm.2019.02.011.
Pichon, A., Bezier, A., Urbach, S., Aury, J.-M., Jouan, V., Ravallec, M., Guy, J., Cousserans, F., Theze, J., Gauthier, J., Demettre, E., Schmieder, S., Wurmser, F., Sibut, V., Poirie, M., Colinet, D., da Silva, C., Couloux, A., Barbe, V., Drezen, J.-M., Volkoff, A.-N. 2015. Recurrent DNA virus domestication leading to different parasite virulence strategies. Science Advances, 1 (10), 9 p. DOI : 10.1126/sciadv.1501150.
Volkoff AN, Jouan V, Urbach S, Samain S, Bergoin M, Wincker P, Demettre E, Cousserans F, Provost B, Coulibaly F, Legeai F, Beliveau C, Cusson M, Gyapay G, Drezen JM. 2010. Analysis of virion structural components reveals vestiges of the ancestral ichnovirus genome. PLoS Pathogens 6(5), e1000923. DOI : 10.1371/journal.ppat.1000923.
Revues récentes sur le sujet (produites par l’équipe)
Volkoff, A.-N., Huguet, E. 2021. Polydnaviruses (Polydnaviridae), in: Bamford, D.H., Zuckerman, M. (Eds.), Encyclopedia of Virology (Fourth Edition). Academic Press, Oxford, pp. 849-857. DOI : 10.1016/B978-0-12-809633-8.21556-2.
Cusumano, A., Volkoff, A.N. 2021. Influence of parasitoid-associated viral symbionts on plant-insect interactions and biological control. Current Opinion in Insect Science 44, 64-71. DOI: 10.1016/j.cois.2021.03.009.
Volkoff, A.-N., Cusson, M. 2020. The unconventional viruses of Ichneumonid parasitoid wasps. Viruses, 12, 1170. DOI : 10.3390/v12101170.
Lorenzi, A., Volkoff, A.-N. 2020. Polydnaviruses, a unique example of viral machinery domesticated by parasitoid wasps. Les Polydnavirus, un exemple unique de machinerie virale domestiquée par des insectes parasitoïdes. Virologie (Montrouge), 24 (2), 113-125. DOI : 10.1684/vir.2020.0835.
Darboux, I., Cusson, M., Volkoff, A. N. 2019. The dual life of ichnoviruses. Current Opinion in Insect Science, 32, 47-53. DOI : 10.1016/j.cois.2018.10.007.